Le RUIM en synthèse
Qu’est-ce que le RUIM?
Le référentiel unique d’interopérabilité du médicament est une terminologie qui décrit de manière historisée l’ensemble des spécialités pharmaceutiques disponibles en France.
Il représente de manière univoque le médicament depuis les substances actives qui le composent jusqu’aux éléments dispensés (présentations et unités communes de dispensation), en passant par le concept de médicament prescriptible en dénomination commune, tel que défini dans l’article R5125-55 du CSP.
Il contient l’ensemble des spécialités allopathiques, phytothérapeutiques et homéopathiques, autorisées ou enregistrées en France. Il contient également les médicaments disponibles dans le cadre d’accès compassionnel ou précoce.
Les utilisateurs cibles
Les utilisateurs cibles du référentiel unique d’interopérabilité du médicament sont tous les acteurs du circuit du médicament (ville, hôpital, etc.)
- Professionnels de santé / Etablissements de santé en production de soins,
- Editeurs de bases de données médicamenteuses,
- Editeurs de logiciels pour professionnels de santé prescripteurs et pour pharmaciens,
- Maitrises d’ouvrage régionales e-santé pour la mise en œuvre d’applications mettant en jeu le médicament,
- Institutions pour le suivi du circuit du médicament,
- Analystes de données en exploitation de données.
Les cas d’usages
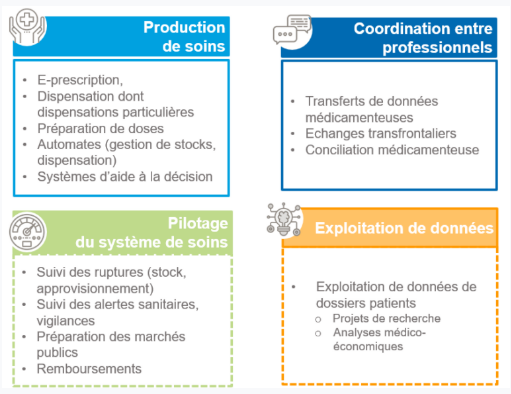
Quatre grandes familles de cas d’usage du référentiel d’interopérabilité peuvent être distinguées :
- Production de soins : pour normaliser l’information émise ou recueillie au moment du soin et pouvoir assurer l’interopérabilité des échanges avec d’autres systèmes d’information ou des systèmes d’aide à la décision, pour faciliter la recherche d’information.
- Coordination de soins : émettre ou recevoir une information pour gérer le parcours de soins d’un patient.
- Pilotage sanitaire : pour normaliser le flux d’information nécessaire à des analyses médicoéconomiques, par exemple produire des indicateurs pour ajuster une action de politique sanitaire (identifier et traiter un problème, allouer des ressources, etc…).
- Exploitation de données et recherche : pour normaliser des données provenant de différentes sources afin de pouvoir les agréger ou les exploiter à de fins de recherche rétrospectives ou prospectives. A noter que la normalisation va permettre d’adosser des systèmes d’aide à la décision aux données échangées, dans le cadre de la production de soins (sécurisation prescription ou de dispensation), dans le cadre de coordination de soins (expertise du parcours de soins), du pilotage sanitaire ou de l’exploitation de données (analyse de signaux).
A noter que la normalisation va permettre d’adosser des systèmes d’aide à la décision aux données échangées, dans le cadre de la production de soins (sécurisation prescription ou de dispensation), dans le cadre de coordination de soins (expertise du parcours de soins), du pilotage sanitaire ou de l’exploitation de données (analyse de signaux).
Le contenu
Le référentiel couvre l’ensemble des médicaments disponibles en France à l’officine ou à l’hôpital. Il inclut :
- Les médicaments ayant une autorisation (médicaments de prescription, médications familiales (produits OTC), autorisations homéopathiques)
- Les médicaments enregistrés : phytothérapie/homéopathie ;
- Les médicaments importés (importation parallèle ou distribution parallèle) ;
- Les médicaments en accès précoce (AAP) ou compassionnel (AAC et CPC).
Le référentiel est élaboré à partir des sources primaires de médicaments disponibles en France et accessibles à tous :
- Spécialités (codes CIS) et présentations (codes CIP) fournies par l’ANSM
- Unités communes de dispensation (codes UCD) fournies par le Club Inter Pharmaceutique
- Médicaments virtuels (codes MV) fournis par l’association Médicabase regroupant les 4 bases de données agréées par la HAS.
- Tableaux des médicaments en accès précoces ou compassionnels produits par la DSS
Chacune de ces sources fournissent en outre des informations associées à ces codes principaux (CIS, CIP,UCD et médicaments virtuels) qui permettent d’avoir une description complète et cohérente du médicament.
Pour répondre à des objectifs de standardisation, le référentiel s’appuie sur 3 référentiels
terminologiques internationaux permettent de renseigner certains attributs du médicament présents dans le référentiel :
- Dictionnaire des substances publié par l’agence européenne des médicaments (Substance
management services) pour la standardisation des principes actifs - Base de données des « standards terms » produite par l’agence européenne du médicament pour normaliser une partie des attributs du médicament (forme pharmaceutique, unité de présentation, voie d’administration) entrant notamment dans la description d’une prescription en Dénomination commune,
- Classification ATC éditée par l’OMS pour regrouper les médicaments et faciliter l’exploitation de séries de données
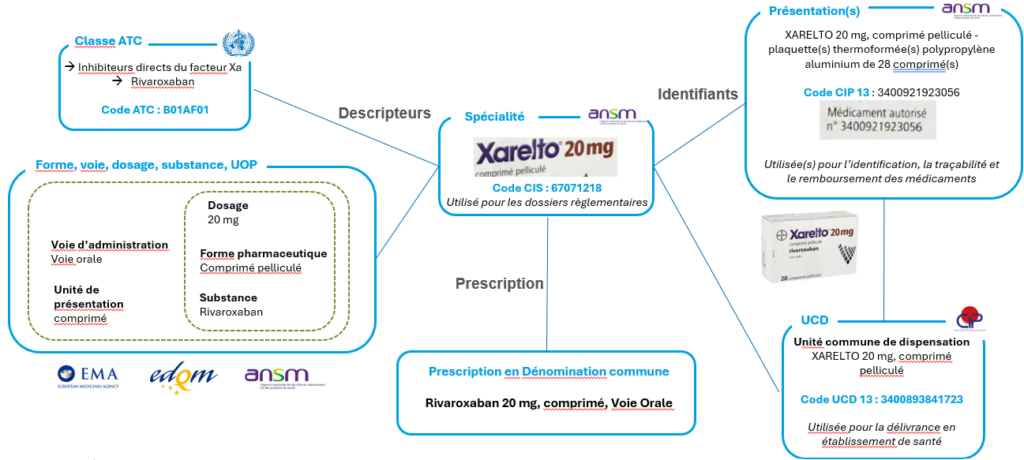
Prenons l’exemple du Xarelto 20 mg :
Alignements avec les autres terminologies
Le référentiel unique d’interopérabilité du médicament est aligné avec d’autres terminologies également publiées sur le SMT.
| Terminologie | passerelle | Lien vers le catalogue |
| ATC | Code ATC | https://smt.esante.gouv.fr/terminologie-atc/ |
| EDQM standard terms Dictionnaire RMS | Les codes formes pharmaceutiques Les codes voies d’administration Les codes unités de présentation | https://smt.esante.gouv.fr/terminologie-standardterms/ https://smt.esante.gouv.fr/terminologie-rms/ |
| Dictionnaire SMS | Les codes substances | https://smt.esante.gouv.fr/terminologie-sms/ |
La recherche d’équivalents thérapeutiques dans des bases étrangères utilisant les mêmes codes descriptifs est possible.
Comment le Ruim est-il structuré?
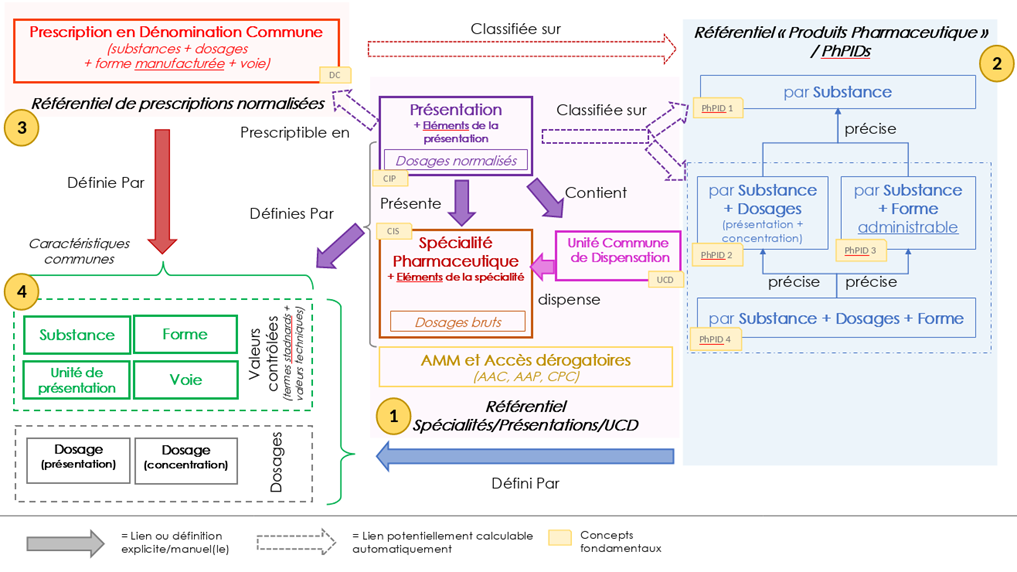
Ce diagramme fait apparaitre 3 “sous-référentiels” autonomes :
- Le référentiel des spécialités pharmaceutiques, avec leurs Unités Communes de Dispensation (UCD) et leurs Présentations. Les Présentations sont d’ailleurs les entités qui permettent de faire les liens “en étoile” avec les autres parties du référentiel.
- Le référentiel des produits pharmaceutiques, qui définit des catégories en fonction de “la composition quantitative et qualitative des médicaments dans la forme galénique approuvée pour l’administration”. Ces catégories sont désignées par l’acronyme “PhPID” (Pharmaceutical Product Identifier) ; elles sont définies à des niveaux de granularité différents :
a. PhPID 1 : par la/les substance(s) active(s) seulement (composition qualitative) (“Paracétamol”).
b. PhPID 2 : par la/les substance(s) active(s) et son/leur dosages (composition qualitative et quantitative) (“Paracétamol 500 mg”)
c. PhPID 3 : par la/les substance(s) active(s) et la forme (composition qualitative avec la forme galénique) (“Paracétamol comprimé” ou “Paracétamol suspension buvable”)
d. PhPID 4 : par la/les substance(s) active(s) et son/leur dosages et la forme galénique) (“Paracétamol 500 mg comprimé”, “Paracétamol 500 mg suspension buvable”)
- Le référentiel de prescription en dénomination commune (ou “prescriptions en DC”) qui spécifie des caractéristiques normalisées des prescriptions (« Paracétamol 500 mg comprimé voie orale », «Paracétamol 500 mg poudre (pour suspension buvable) voie orale »).
Ces 3 parties sont chacune définies de façon formelle sur des caractéristiques communes : les substances (substances actives ou fractions thérapeutiques), les formes (formes manufacturées dans les libellés de prescription, formes administrables dans les produits pharmaceutiques), les voies d’administration, les unités de présentation (seulement pour les prescriptions en DC) et les dosages, ceux-ci étant de 2 sortes :- Les dosages concentration : concentration de la substance par unité de volume ou de poids et indépendamment d’une quantité totale (“5 mg/mL”)
- Les dosages présentation : quantité de substance totale, éventuellement par rapport à la quantité totale d’une présentation (“300 mg” (pour un comprimé) ou “25 mg / 5 mL”(pour un flacon de 5 ml)).
L’utilisation combinée des dosages présentation et dosages concentration est fonction de la forme des médicaments (on aura parfois seulement un dosage de présentation – avec ou sans quantité totale de la présentation, parfois seulement un dosage de concentration, parfois les deux).